mRNA疫苗技术具备研发周期短、安全性优良、生产技术通用性强的特点,但由于mRNA疫苗的特殊工艺,传统的生物制品厂房设计已不能完全满足其制备要求。科学合理的厂房工艺设计是确保mRNA疫苗产能与质量的主要条件,因此,如何设计既符合工艺要求又满足兽药GMP的动物mRNA疫苗生产厂房成为摆在我们面前急需探究的课题。鉴于不同国家在能源结构、环保要求、设计理念等方面存在差异,在借鉴欧美已有的mRNA疫苗规模化生产设施和我国人用mRNA疫苗厂房设计的基础上,提出了符合我国兽药GMP规范的mRNA疫苗厂房生产设施、工艺关键点和设计方案,以期为国内动物mRNA疫苗车间建设提供参考。
[关键词]动物;mRNA疫苗;生产设施;工艺设计;GMP
mRNA疫苗技术是疫苗开发领域的一项重大进展,具备高效、研发周期短、安全性优良、生产技术通用性强的特点。mRNA技术是一种将人工合成的mRNA分子引入细胞内,并利用细胞自身的翻译机制来将其转录成蛋白质的技术,已有几十年的研究历史。新冠疫情暴发后,Moderna利用该技术仅用了42天即完成了新冠mRNA候选疫苗mRNA-1273的构建和筛选,并于2020年3月获得FDA批准正式开始评估安全性和免疫原性的I期临床试验,试验结果显示该候选株的免疫保护性可达94.1%。2020年12月辉瑞和Moderna分别研制的mRNA疫苗均获得美国食品安全局的紧急使用授权(EUA),成为疫苗史上最快研制上市的疫苗,标志着mRNA技术正式应用到COVID-19临床预防。随着mRNA技术的发展以及在新冠疫情防控中的应用,该技术成为生物医学领域的研究热点,得到了极大的关注,并获得了2023年诺贝尔生理学或医学奖。作为一种潜力巨大的新型技术,无论是出于预防目的还是治疗用途,以及作为新型治疗药物的基础,诸多国内外企业正快速推进相关mRNA制品的研究与应用。截至2023年12月,美国ModernaTherapeutics公司原研的mRNA疫苗产品数量最多,一共有28个;美国的AlphaVax公司和比利时的ZiphiusVaccines公司原研疫苗各10个;中国的斯微生物(StemiRNA)和苏州艾博生物(AnbogenBiosciences)公司分别有9个和2个产品在研,其中包括艾博生物的ARCoVax疫苗和丽凡达生物旗下的LVRNA009,这两种疫苗都已经步入了Ⅲ期临床试验。沃森生物、石药集团等研究成功的新冠mRNA疫苗于2023年12月被我国国家药监局获批纳入紧急使用。mRNA疫苗是通过合成和转录等技术制备得到的核酸制剂,通过特定的递送系统将外源的目的基因序列导入机体细胞,从而表达目的蛋白并激发机体产生特异性免疫反应,以实现免疫保护。mRNA注射进入体内发挥作用,但其本身不进入细胞核,避免了外源性DNA污染的风险,具备较高的安全性。与传统疫苗相比,mRNA疫苗采用DNA模板并通过无细胞酶促转录反应进行生产。这种生产工艺相对简单,能够快速实现大规模生产。同时,mRNA疫苗的配方设计和生产步骤具备可复制性,有助于缩短研发生产周期。当前,国内动物mRNA研发的积极性很高,急需根据mRNA疫苗产业化生产工艺相对稳定的特点,结合相关法规要求,借鉴并参考人mRNA疫苗车间设计理念,通过全面分析人mRNA疫苗产业化车间功能区布局、洁净区域划分、人流和物流走向、压差分布以及气流方向等方面特点要求,在探究动物mRNA疫苗厂房工艺设计的关键点与核心要素的基础上,提出可供参考的方案,以期为国内动物mRNA疫苗生产厂房的建设与管理提供参考。
从人用mRNA疫苗车间看,制造mRNA疫苗的过程一般分为三个关键阶段:首先是质粒DNA(plasmidDNA,pDNA)模板的制备,接着是mRNA药物成分(drugsubstance,DS)的合成,最后是其装载入传递系统并完成制剂的最终灌装。这一系列步骤中至关重要的是从pDNA模板的生产到mRNA药物物质的合成等核心工艺的工程设计。
在产业化规模下,pDNA的生产通常采用大肠杆菌为宿主的系统进行。这个流程包括大肠杆菌的发酵作为上游过程,继而是收集与裂解菌体,最后是下游的pDNA提纯和溶液的灌装。在经过优化构建的pDNA系统中,目标质粒在大肠杆菌中通过发酵过程被表达,接着通过裂解过程释放到培养上清液中。后续的澄清过滤及色谱纯化等步骤将用于去除细胞残留物、RNA和线性DNA等杂质。目前,pDNA的生产技术相对成熟,并已有详尽的操作流程。
mRNADS的生产工艺包含数个关键步骤:起始于上游的pDNA线性化,随后进行体外转录(invitrotranscription,IVT),然后进入下游的mRNA纯化过程,以及最终的原液灌装。在这其中,特别需要注意的是,pDNA的生产过程最终产出的是超级螺旋(supercoiled)pDNA,这种形式的pDNA比线性化的pDNA结构更加稳定,更适合长期储存。尽管如此,如果通过验证确认线性化pDNA在特定条件下能够保持稳定性,线性化过程可作为pDNA制造后的一个附加步骤。这样获得的线性化pDNA可在冻存之后直接应用于IVT过程。
目前,mRNA药物成分(DS)的生产过程尚未形成一套通用和标准化的生产流程,市场上已上市或正在开发中的产品采取了不同的生产技术路径,包括上游合成、下游处理方面,如图1A所示。目前在人药有两种获得批准的mRNA疫苗生产方法,其上游合成阶段的差异是用于加成5’帽的技术选择不同,一种是在转录过程中同时进行帽的添加(共转录加帽,即一步法),而另一种方法则是在转录完成后再加帽(转录后加帽,即二步法),如图1B所示。
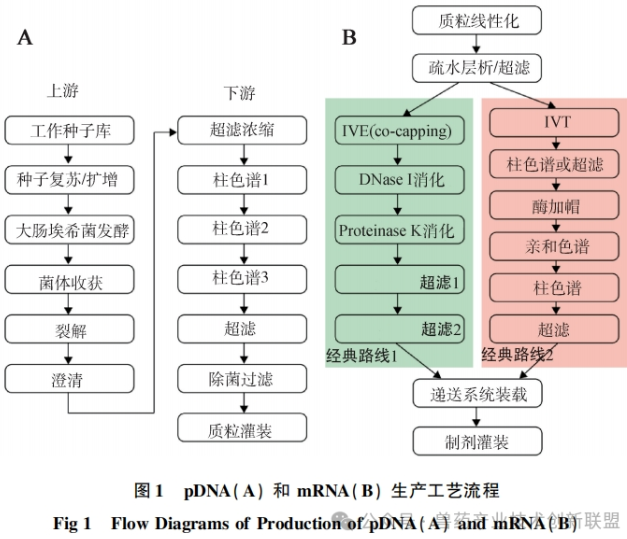
在制备mRNA疫苗时,一步法是在IVT的同时结合引物,类似于BioNTech公司用于BNT162b2疫苗的技术;二步法则是先进行IVT,随后加入加帽酶进行结合,这是Moderna公司在生产其mRNA-1273疫苗时所采用的技术。
在纯化mRNA的过程中,不同的公司采用的方法不尽相同。一般研究中的纯化过程通常采纳类似于Moderna公司使用的双色谱分离技术。纯化的第一阶段是使用OligodT亲和色谱法,它依赖于OligodT与mRNA的polyA尾端的特异性结合,以实现从合成混合物中分离mRNA,从而有效移除未参与反应的试剂和DNA模板等。但是,这个步骤不能清除大量的双链RNA(dsRNA)。纯化的第二阶段通常采用疏水色谱或离子交换色谱技术,这些技术有助于除去可能激发人体免疫反应的dsRNA和截短的RNA杂质。去除dsRNA杂质,还可以使用反相离子对色谱法,这种办法对dsRNA的清除率相对较高,但这种方法大量使用有机溶剂。因此研究应用时,对环境可能造成的影响也需纳入考量。
鉴于mRNA疫苗生产过程并没有完全统一的路线,现阶段生产车间的设计必须具备一定的灵活性,以适应后续可能出现的各种不同的制造工艺需求。mRNA因其针对的目标和途径的不同而需要不同的生产规模。例如,在应对全球性流行病时用于预防的COVID-19疫苗需求量可达到数十亿剂量。而对于其他种类的传染病,比如季节性流感或特定类型肿瘤的预防和治疗疫苗,虽然它们可能需要适配更多的治疗方式,但每个特定应用的人群规模预计将达数百万。除此之外,还存在着对极为专门化治疗需求的个性化疗法,这可能涉及到对单个特种病定制的产品,其生产规模相对较小,仅为微克到毫克级别。参考市场上已获批准的BioNTech/Pfizer和Moderna的COVID-19mRNA疫苗的产品信息(见表1),并以每年生产10亿剂疫苗的生产规模为案例,深入分析相关工艺设计问题。

根据文献,基于规划的年度产能目标,设定为mRNA物质每年30kg。采用反应转化率为100、以及过程收率为70%的参数进行产能需求计算,得出所需pDNA的年度产能为428.6g。在每个生产批次中,若投入4.3g的pDNA,并且按照70%的过程收率计算,每批能收获的mRNA为301g。考虑到mRNA的单批生产周期为3天,一年内可进行约100个生产批次。据此估计,mRNA的年度产能至少达到或超过30.1kg,从而才能满足预定的年度产能要求。
综合上文分析,pDNA年度产能需求为每年428.6g。应用体积为50L的发酵罐进行生产时,考虑到pDNA的表达量为0.2g/L,并且以50%的收率估算,预计每一批次产出约为5g的pDNA[16]。假设每批pDNA的生产周期为5天,并且批次之间的生产间隔设定为3.5天,那么在一个年度周期内,至少可以完成88个生产批次。据此,年度pDNA产量至少需要达到440g,才能充分满足年度产能要求。
在不对现有生产设施进行改进的前提下,通过减少年度生产批次,可将生产班次从三班制调整为两班制,或是调降mRNA药物成分(DS)生产过程中单批次的投料量至使得体外转录(IVT)过程中药物浓度维持在2~5g/L的水平,实现生产线的灵活调整,以支持每年生产最多7500万剂(每剂100μg)的疫苗。这样的产能能够满足预防和治疗目的mRNA疫苗的目标群覆盖需求。
根据文献资料就人用mRNA疫苗生产制造工艺布局、人员与物料流向、洁净区的划分、压力设计和气流走向等要素进行分析介绍,见图2。
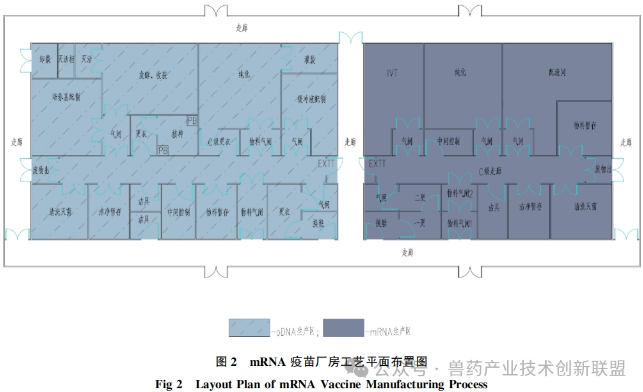
在生产布局规划中,设置两个生产区域:一个是50L规模的质粒生产区,另一个是同样规模的mRNA药物成分(DS)生产区。与传统的抗体制造设备相比,这些设备的规模较小。要求无菌条件下进行的灌装工作必须在无菌车间内进行,而这一部分的工艺设计已经相当成熟,因此重点关注pDNA和mRNADS的生产过程的工艺布局。生产无菌的mRNADS对环境条件有较高要求,在工艺布局设计时将其与大肠杆菌的生产线彻底隔离,并单独设置,使用不同的空调系统,防止交叉污染。如图2展示的,左侧区域是pDNA的生产区域,而右侧是mRNADS的生产区域。pDNADS的生产线包括以下功能间:接种间、发酵和收获间、纯化间以及灌装间。与此同时,培养基的配制间与上游工段邻接,而缓冲液的配制间则紧邻下游工段,以实现物料传输的最短距离。其他辅助空间包括清洗和灭菌间,以及微生物废物灭活间等。在mRNADS的生产车间中,关键工序操作间主要包括IVT间、纯化间,配液间与纯化间相邻,方便使用。此外,还配备了清洗和灭菌间,中间过程的控制室,以及材料暂存间等辅助功能间。传统工艺布局理念,可以按照类似于实验室的“大通间”设计思路用在mRNADS的生产车间设计方面,即把IVT和纯化过程安置在同一功能间内。这种布局具有工艺切换灵活、节约空间等优势,但是需要对潜在的上下游交叉污染问题进行充分的风险评估。
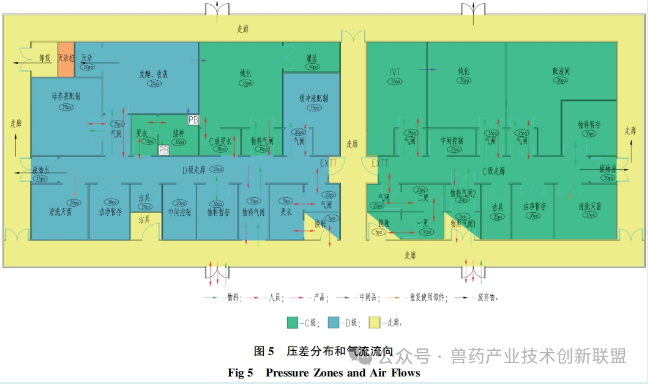
生产pDNA时对操作环境洁净度的设置,遵循GMP要求。在pDNA生产过程中,用于培养大肠杆菌其所在背景环境为C级洁净区。发酵过程若是封闭操作,所推荐的洁净级别为D级以上。在纯化阶段,可在C级环境下进行。如图3所描述,人员与物料的出入口设有气闸间。通过在人员或物料进出时控制空气流动,尽可能降低微生物及其他污染源的介入。在换穿洁净服之后,pDNA生产人员进入D级洁净区的走廊,在前往接种间之前,需更C级洁净衣。与此类似,纯化室的工作人员在进入相关功能间之前,同样需更C级洁净衣。物料通过专设的物料气闸间,经过外清洁后进入洁净区。废弃物由专设废物气闸间转出,接着被运送至北侧。此类平面布局通过气闸间将发酵间、纯化间等可能产生污染的区域隔离开来,确保D级共用通道的相对洁净状态。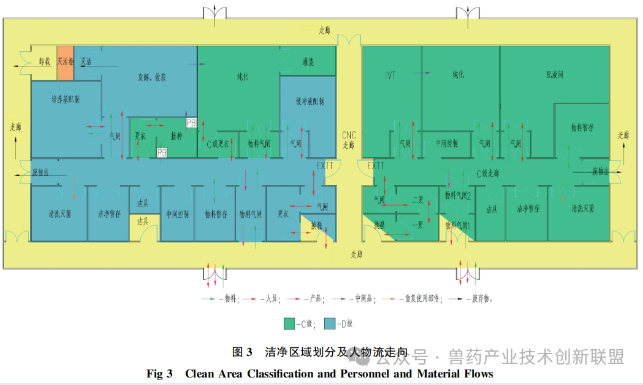
在mRNADS的生产区,由于最终产品需经无菌过滤,因此整个制造区是按照C级洁净标准而设计的,以控制过程中的生物载量。在其进出口同样设有供人员及物料专用的气闸间。在更C级洁净服后,人员可进入C级洁净区走廊及其它功能空间。IVT和纯化是两个关键的核心功能间,通过设置气闸间来降低交叉污染的风险。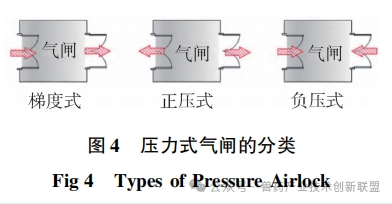
洁净室入口处的气闸室设计起着关键作用,其遮挡外部的污染空气并且调整压力差异。根据空间的特定需要,设置梯度式(cascade)气闸间、正压式(bubble)气闸间和负压式(sink)气闸间等多种形式,如图4所示。梯度式(cascade)气闸间适用于需要保持一定洁净等级但无隔离需求的场所,或者有隔离需求但不要求严格洁净度的场所。正压和负压风闸适宜用在既有洁净度要求又需产品隔离的场合。如图5所示,mRNADS的更衣空间采取了渐变压力风闸设计,用以确保合适的洁净水平。C级通道与各关键功能区之间,正压风闸的设置有助于阻止区域间空气交叉流通,保持洁净室内的洁净等级,并有效避免各操作间的空气外泄。与此相似,pDNA生产区域以及发酵和收获间与D级通道之间也采用正压气闸设计,以防止潜在的带菌空气污染D级洁净走廊。纯化间则涉及pDNA原液的无菌过滤与包装,因此与D级洁净走廊之间应用了梯度式气闸间,确保气流从纯化区向D级洁净走廊流动,预防走廊内的气流倒流,避免影响产品的质量。
人mRNA疫苗车间设计理念对动物mRNA疫苗车间设计的启示笔者通过对国内外人药法规管理以及资料、文献查询,结合对国内某公司的mRNA疫苗生产车间进行了调研和学习交流,根据兽药GMP相关要求,对动物mRNA疫苗生产线的工艺布局进行了探究与思考,提出了供兽药行业参考的建议。mRNA疫苗的制造始于以pDNA为模板的过程,通过酶的作用,从pDNA转录出mRNA。欧盟法规允许生物技术公司将此类pDNA的制作外包给专业的合同制造机构(contractmanufactureorganization,CMO),并把这一环节作为原材料监控的一个部分。与此不同,《中华人民共和国疫苗管理法》及《新型冠状病毒预防用疫苗研发技术指导原则(试行)》规定,在中国境内,pDNA模板被归类为原液生产的一部分,要求相关企业必须自行制造pDNA。而我国动物疫苗GMP管理实践中,也需将其作为生产的一部分。鉴于这些差异以及对技术平台完善性及将来应用的灵活性的考虑,动物mRNA疫苗的制造流程可从pDNA的制备着手,重点关注pDNA与mRNA原液制备的关键工艺流程和与其相应的工艺工程设计细节。
根据目前动物mRNA疫苗的生产工艺,其生产线核心功能区通常可分为5个区域(平面布局参见图6):发酵和收获区、pDNA纯化区、IVT区、LNP区和无菌罐装区,这5个区域应分别设置且相互独立,不同区域的人流和物流应分开设置,与mRNA疫苗生产相配套的仓储区和质检区可参考常规兽药GMP的工艺设计。
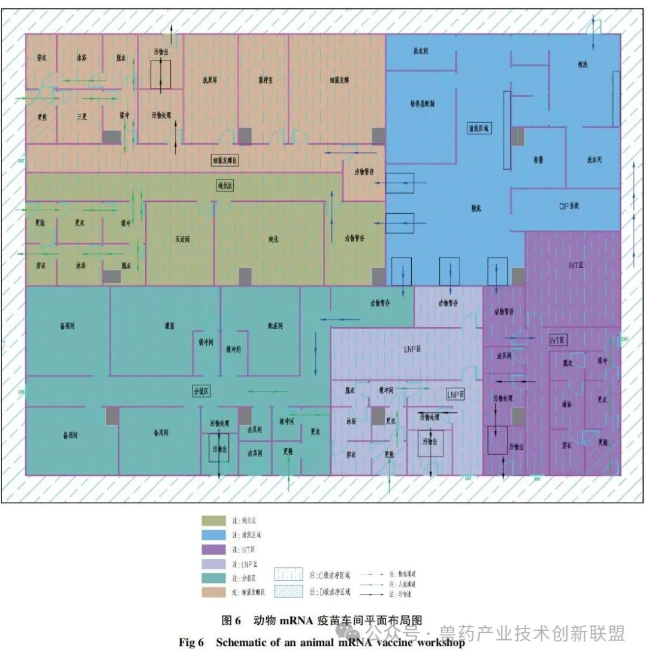
发酵和收获区,主要是采用不同规格的发酵罐对大肠杆菌进行发酵,然后通过碟片离心机或冷冻离心机收集菌体,再对菌体进行裂解,离心后收集上清。pDNA纯化区,主要是通过超滤浓缩-层析-超滤等方式对获得的pDNA进行逐级纯化,在纯化区的末端可设置酶切反应罐,对纯化后的pDNA进行线性化。IVT区,主要是对pDNA进行体外转录,然后超滤或者层析,进行加帽修饰,亲和层析,最后再经过一次超滤后,保存或进入下一道工序。LNP区,主要是对体外转录后的mRNA进行包装,通常采用微流体动力学技术将mRNA和LNPs混合,使mRNA被脂质颗粒所包裹,根据需要可加入防冻剂等稳定剂。无菌罐装区,主要是将制剂灌装到小瓶或预装式注射器中。
除了生产车间配置之外,mRNA疫苗的生产还需辅以适当的质量控制(qualitycontrol,QC)实验室,以进行原料、中间产物和最终产品的检测工作。例如,在pDNA生产时对细菌种子的检测、超螺旋质粒的纯度、残留和微生物限度的质量控制等。同时,车间所使用的部分原料和辅料,比如特定的酶,可能需要在特定温度下储存;与此类似,mRNA疫苗的原液和成品也对保存温度有明确要求。例如,BioNTech/Pfizer的疫苗最终产品需储存在-80~-60℃的条件下,而Moderna的mRNA疫苗最终产品的储存温度为-25~-15℃。由此,存储区域需配备相匹配的冷藏设备,比如冰箱或冷库,工艺布局设计中需包含这一考量。此外,在递送系统的装载过程中,可能会使用甲级的乙醇溶液进行稀释,这就需要考虑防爆的标准和措施。
mRNA疫苗目前正在进入从实验室研究向产业化生产的转型期,展现出巨大的市场潜力。然而,它仍须跨越多项技术难关才能成功实现。迄今,人药物领域国外只有Moderna、BioNTech/Pfizer的COVID-19mRNA疫苗分别获得了FDA和EMA等监管机构的紧急使用授权,国内只有沃森生物、石药集团等研发的新冠mRNA疫苗被国家药监局批准纳入紧急使用。相比之下,动物mRNA疫苗研发大多停留在临床前研究阶段,缺乏在兽用GMP标准下进行产业化生产经验,同时也缺少相关的质量控制和监管先例作为参照。工厂设计应既具备前瞻性,以应对潜在的生产能力扩张,同时又需避免过度设计,以免造成初期投资过高。这要求对疫苗产品本身的特性及市场未来的发展趋势有充分的了解和预判。本研究旨在为国内动物mRNA疫苗生产平台的建设和发展提供思路。








